Publicado: junio 10, 2021, 10:30 am
The Conversation
Antonio Gutiérrez Pizarraya, Salud Pública Andalucía
En recientes declaraciones, uno de los responsables de BioNTech, el laboratorio colaborador de Pfizer en su vacuna de ARNm, afirmaba que será necesaria una tercera dosis de esta vacuna.
En la población general, con un estado de salud adecuado y sin enfermedades de base, parece poco probable que vaya a ser necesaria una tercera dosis. ¿Pero qué pasa con los pacientes inmunodeprimidos?
Se conoce como inmunosupresión a la situación en la cual existe una supresión o disminución de las reacciones inmunitarias. Es decir, el sistema inmunológico no hace sus funciones correctamente o de forma completamente normal. Esta situación puede originarse o bien por el empleo de tratamientos que inducen esta situación en nuestro cuerpo, o bien porque padecemos alguna enfermedad que lo provoca.
El trasplante de órganos o hematológico, el VIH, el cáncer, inmunodeficiencias, enfermedades autoinmunes o reumáticas, o incluso la malnutrición, serían algunos ejemplos.
Lo de los trasplantes de órganos tiene que ver con que los receptores toman medicamentos para suprimir el sistema inmunitario para que el cuerpo no rechace el órgano recién implantado. En cuanto al cáncer, ya sea por la misma enfermedad o por la quimioterapia que es necesaria en ocasiones, nuestro organismo se encuentra en una situación similar.
Las vacunas COVID-19 estimulan al sistema inmunológico para que genere una respuesta, en este caso contra el virus SARS-CoV-2, de forma que cuando se presente sin avisar estemos preparados.
La pregunta más inmediata entonces sería si esas “defensas” que han de encargarse de parar al virus van a ser capaces de pelear bien si están algo debilitadas, y por tanto si esas personas deberían vacunarse. La respuesta corta es que si.
Qué sabemos del efecto vacunal en estos pacientes
Es pronto para saber cómo de potente es la respuesta de nuestro organismo en situación de inmunosupresión contra el virus cuando nos vacunamos. Lo que sí sabemos es que, en estos pacientes, las vacunas son seguras.
Aun siendo pronto, vamos teniendo pistas que indican que en estos pacientes la respuesta a las vacunas sería diferente al resto.
Por ejemplo, en pacientes trasplantados de órgano, como el riñón, la respuesta humoral basada en anticuerpos neutralizantes en pacientes trasplantados de órgano sólido parece más pobre.
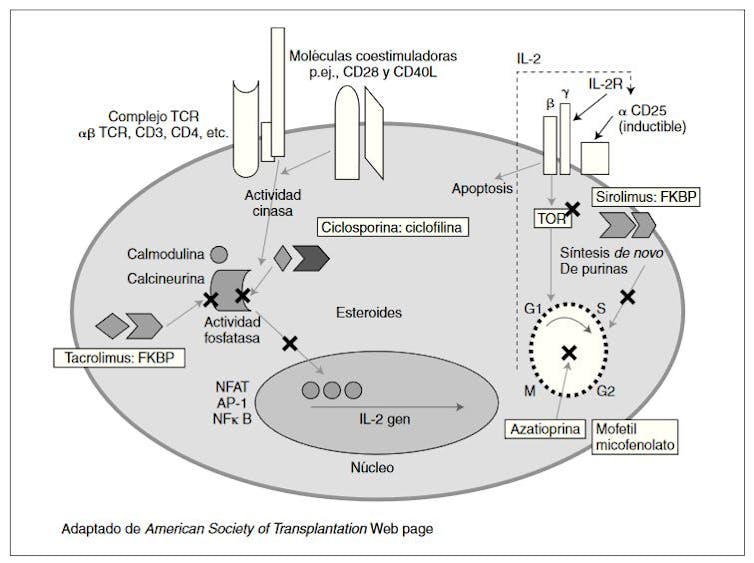
Hay indicios también de que fármacos muy usados como inmunosupresores, entre ellos el micofenolato de mofetilo (que inhibe la proliferación de linfocitos T y B), pueden tener efecto negativo en la actividad postvacunal de anticuerpos.
En pacientes con enfermedad inflamatoria intestinal, como la enfermedad de Chron, también hay evidencias de una respuesta disminuida, aunque el tipo de terapia juega un papel importante.
Por otro lado, en personas con fármacos antirreumáticos la respuesta también cambia según, sobre todo, el tipo de fármacos utilizados. Con uno en concreto, llamado rituximab, muy empleado también en enfermedades hematológicas, renales, y reumáticas, entre otras, según un estudio publicado en BMJ, no hubo seroconversión (producción de anticuerpos) tras vacunación (0% si se había tratado menos de 6 meses, 90% si el tratamiento había durado más de 12 meses). Por el tipo de estudio, las conclusiones no pueden ser tomadas por definitivas, pero sí hay que tenerlo en cuenta.
Pero también hay datos favorables. La respuesta celular, parece conservada en pacientes trasplantados.
Adicionalmente, en pacientes con cáncer con quimioterapia intravenosa y a los que se les administró una vacuna de ARNm, a pesar de observarse que, tras primera y segunda dosis se detectaban Acs neutralizantes sólo en el 67 y 80% de los pacientes, la actividad celular era similar a los pacientes controles con los que se comparó y que no tenían cáncer.
De hecho, según un estudio de hace unos días en trasplantados de hígado e inmunosuprimidos, la respuesta inmunitaria mediada por células T, generada por el cuerpo tras superar la enfermedad, fue comparable a pacientes no trasplantados. Y esto no es baladí porque son precisamente esas células las encargadas de producir anticuerpos y de “recordar” al invasor en posteriores exposiciones.
En pocas palabras, las evidencias hasta el momento son dispares así que se hace difícil emitir recomendaciones generales que sirvan para todo tipo de inmunosupresión.
¿Tercera dosis sí o no?
Como explicábamos al principio, una de las cuestiones que se plantean es si en estos pacientes haría falta una tercera dosis de “refuerzo” para conseguir una actividad óptima. Parece poco probable que vaya a ser necesario para la población general, sobre todo después de salir a la luz algunos datos que hablan de una duración permanente.
Pero en los pacientes con inmunosupresión o inmunodeficiencia, descartar una posible tercera dosis parece aventurado todavía, porque carecemos de datos sólidos al respecto. Ha habido un caso de un médico especialista en trasplantes de NY, trasplantado de corazón y con medicación inmunosupresora, que recibió doble dosis de Pfizer y que no alcanzó buena respuesta. Tras esto, recibió una tercera con Janssen, tras la cual sus niveles de Acs y de linfocitos aumentaron. Pero sólo es un caso, claro.
Lo que sí sabemos con seguridad es que la pauta, de dos dosis salvo en el caso de la vacuna de Janssen (monodosis), debe ser completada en todas las personas, pero sobre todo en este tipo de pacientes inmunodeprimidos.
¿Deben vacunarse entonces los inmunodeprimidos?
Actualmente, el beneficio de la vacuna supera cualquier riesgo o posibilidad de nuevas reacciones autoinmunes o brotes de enfermedad después de la vacunación. A excepción de antecedentes alérgicos tras la primera dosis o alergias existentes a los componentes de la vacuna, no existen contraindicaciones conocidas.
Pacientes en situación de inmunosupresión están en una situación de mayor riesgo de contraer la COVID-19 así como de tener un peor pronóstico en caso de infectarse. A pesar de que puede que la respuesta a la vacuna esté disminuida en estos pacientes, podría protegerles en cierta medida de desarrollar una enfermedad grave, hecho muy relevante. Además, como sabemos que son seguras y que no ocasionan problemas, más razón para recomendarlas.
Por otro lado, sabemos que, en ciertas ocasiones, en estos pacientes el virus puede permanecer replicándose un tiempo más prolongado de lo habitual, favoreciendo la aparición de variantes con más capacidad de escape a la inmunidad. Se sabe incluso de un caso de un paciente con leucemia en el que el virus persistió en su organismo hasta 197 días después del diagnóstico, sin ocasionar síntomas, y desarrollando cambios mayores en su estructura.
Por lo tanto, para evitar esto, la vacunación rápida y completa de estos pacientes cobra aún más relevancia. También por el beneficio de la colectividad.
Además, ya se están confeccionando estrategias para optimizar la respuesta vacunal en función del tipo de fármaco empleado en cada paciente según la farmacoterapia.
Pero obviamente, necesitamos estudios sólidos sobre la verdadera repercusión de esta condición en la respuesta a la vacunación. Por patología y por tipo de tratamiento usado. Es vital que podamos identificar qué fármacos, a qué dosis, y durante cuánto tiempo deberían poder ser usados para evitar una reducción de la respuesta a las vacunas. La incertidumbre hace mella en estas personas.
Para concluir, los pacientes inmunosuprimidos deben vacunarse, con prioridad, independientemente de su edad, y con la pauta completa, por supuesto. Debería poder ser estudiada su respuesta particular a la vacuna tras la misma, y sus convivientes deberían también ser vacunados (aunque no les toque). Y guardar medidas de precaución excepcionales.![]()
Antonio Gutiérrez Pizarraya, Investigador Doctor y Epidemiólogo. UGC Farmacia. Hospital Universitario de Valme., Salud Pública Andalucía
This article is republished from The Conversation under a Creative Commons license. Read the original article.